Zelluläre Grundlagen von Lern- und Gedächtnisvorgängen
Forschungsbericht (importiert) 2003 - Max-Planck-Institut für Neurobiologie
Die Fähigkeit, etwas zu lernen und im Gedächtnis zu behalten, ist über das Tierreich nicht gleich verteilt. Bei uns Menschen beispielsweise sind Effektivität und Kapazität von Lern- und Gedächtnisvorgängen besonders stark ausgeprägt. Unsere diesbezüglichen Fähigkeiten sind neben unserer Sprache Grundlage und Voraussetzung unserer Kultur und unserer individuellen Persönlichkeit. Umgekehrt führt der Verlust des Gedächtnisses zum Verlust fast aller kognitiven Fähigkeiten. Was sind die zellulären Grundlagen dieser phänomenalen Lern- und Gedächtnisfähigkeit, die menschliche und tierische Gehirne zeigen?
Wichtig für das Verständnis der Untersuchungen über die zellulären Grundlagen von Lern- und Gedächtnisvorgängen sind die Kontakstellen zwischen Neuronen, die Synapsen. Diese können in der Stärke reguliert werden. Dies kann nach einer von dem kanadischen Psychologen D.O. Hebb formulierten assoziativen Lernregel erfolgen: Dabei kommt es zu einer physiologischen oder morphologischen Verstärkung der Synapse nach simultaner Erregung der prä- und postsynaptischen Zellen. Dieses Phänomen wird auch als Langzeitpotenzierung (long-term potentiation, LTP) bezeichnet.
Biochemische Abläufe bei der Langzeitpotenzierung
Obwohl LTP einer der am besten untersuchten neurobiologischen Prozesse ist, ist dennoch unklar, durch welche Signalwege die Langzeitpotenzierung aufrechterhalten wird und inwieweit dabei strukturelle Veränderungen an Neuronen eine Rolle spielen. Dennoch ist zumindest teilweise klar, welche biochemischen Ereignisse an bestimmten Synapsen im Säugergehirn für die Induktion synaptischer Verstärkung verantwortlich sind. Am detailliertesten untersucht sind diese biochemischen und molekularen Ereignisse im Hippokampus von Nagetieren. Hier konnte gezeigt werden, dass der Grund für die hohe zeitliche Koinzidenz der Reize (Assoziationsregel von Hebb) auf molekularer Ebene an den Eigenschaften des spannungs- und ligandenabhängigen NMDA-Rezeptors liegt. Offen ist die Frage, welche weiteren Faktoren bei der Induktion und Aufrechterhaltung einer LTP eine Rolle spielen.
Auf der Suche nach Mediatoren und Modulatoren synaptischer Plastizität
In diesem Kontext haben wir besonders eingehend die Rolle des "Brain-derived-neurotrophic-factor" (BDNF) untersucht. BDNF gehört zur Genfamilie der Neurotrophine und wurde in Martinsried am MPI für Psychiatrie (heute MPI für Neurobiologie) entdeckt. Neurotrophine wurden bis vor wenigen Jahren vor allem unter dem Aspekt der Regulation des Überlebens und der Differenzierung bestimmter Neuronenpopulationen in der embryonalen Entwicklung und in der Aufrechterhaltung spezieller Funktionen dieser Nervenzellen im adulten Tier gesehen. Es gibt zwei Rezeptorklassen, an die Neurotrophine binden: Einerseits die zu den Tyrosin-Kinasen gehörenden Trk-Rezeptoren. Daneben gibt es noch ein zweites Rezeptorsystem, den Neurotrophin-Rezeptor p75, der alle Neurotrophine binden kann und keine Kinasedomäne besitzt.
Im Laufe der letzten Jahre ist gezeigt worden, dass Neurotrophine auch an aktivitätsabhängiger synaptische Plastizität im heranwachsenden und adulten Gehirn von Säugetieren beteiligt sein könnten. Insbesondere konnte für BDNF gezeigt werden, dass es die synaptische Transmission steigern kann und dass es die postsynaptische Membran mithilfe von Natriumkanälen, die an TrkB-Rezeptoren gekoppelt sind, depolarisieren kann.
Um die Fragestellung zu beantworten, ob BDNF an der Induktion von LTP beteiligt ist, haben wir in Zusammenarbeit mit der Arbeitgruppe von Hans Thonen, BDNF-defiziente Mäuse untersucht, die mit der Methode des gezielten Genaustausches hergestellt worden waren. Diese Methode beruht darauf, dass das zu erforschende Gen ausgeschaltet wird, indem man an der entsprechenden Stelle auf dem richtigen Chromosom einen Teil oder die gesamte Nukleotidsequenz des Gens durch eine geeignete andere Sequenz mithilfe der homologen Rekombination ersetzt. Sie wird als gene targeting (gezielter Genaustausch), die daraus resultierenden Mäuse als knock-out (KO)- Mäuse bezeichnet.
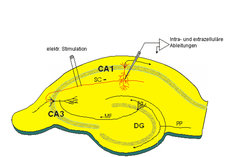
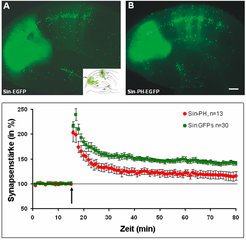
An den BDNF-KO-Mäusen haben wir nun speziell untersucht, ob die synaptischen Verknüpfungen zwischen CA3-CA1-Pyramidenzellen in akuten hippocampalen Schnitten verändert waren (Abb. 1). Dabei konnten wir zeigen, dass in homo- und heterozygoten BDNF-KO-Mäusen die Häufigkeit der LTP-Induktion und auch die Stärke der LTP-Expression vermindert sind. Alle Kontrollexperimente im Hippokampus dieser BDNF-KO-Tiere ergaben bezüglich der synaptischen Transmission, der Pharmakologie sowie der Morphologie der Neurone und der Anatomie des Hippokampus keine Unterschiede zu Mäusen des Wildtyps. Aber zeigen die Tiere ein verändertes Lernverhalten? - Die homozygoten BDNF KO-Tiere sind nur 20 - 30 Tage nach der Geburt lebensfähig, mit ihnen kann man keine Verhaltensuntersuchungen machen. An dieser Stelle halfen uns Mäuse, bei denen der Rezeptor für BDNF (der TrkB-Rezeptor) erst postnatal ausgeschaltet wird, sodass keine Entwicklungsdefekte zu beobachten sind und die Tiere eine normale Lebensfähigkeit haben (Kollaboration mit Rüdiger Klein, damals EMBL, Heidelberg). Das stark eingeschränkte Lernverhalten in TrkB-KO-Tieren deutete auf eine Rolle von BDNF und dem TrkB-Rezeptor bei aktivitätsabhängiger synaptischer Plastizität hin, bei der bestimmte Lernvorgänge entscheidend moduliert werden. Interessant ist vor allem die Beobachtung, dass in den BDNF- und TrkB-KO-Tieren auch die langanhaltende LTP (L-LTP), welche als Voraussetzung für das Langzeitgedächtnis angesehen wird, stark eingeschränkt ist. In weitergehenden Untersuchungen konnten wir, wiederum in Zusammenarbeit mit der Arbeitsgruppe von Rüdiger Klein, zeigen, dass die Signalkaskade über die das BDNF/TrkB-System eine LTP-Induktion und -Aufrechterhaltung erleichtert, über ein Enzym funktioniert, welches durch eines seiner Spaltprodukte (IP3) Calcium aus internen Speichern freisetzt. Dieses zusätzliche Calcium könnte ein entscheidender Trigger vor allem für L-LTP sein, was es in weiteren Experimenten zu untersuchen gilt. Mittlerweile konnten wir auch zeigen, dass BDNF über den TrkB-Rezeptor sowohl prä- wie postsynaptisch die Induktion und Aufrechterhaltung einer LTP positiv regulieren kann (Abb. 2).
Hippocampale Plastizität im Rückwärtsgang
Aber auch andere transsynaptische Liganden-Rezeptorsysteme beeinflussen die Verstärkung - oder auch Abschwächung - einer synaptischen Verbindung. Zusammen mit der Abteilung Molekulare Neurobiologie (Direktor: Rüdiger Klein) haben wir untersucht, welche transsynaptischen Signalwege hieran beteiligt sein könnten. Bei der Übertragung von einem Neuron auf ein anderes sind Proteine an der Synapse beteiligt, die sich an der Membran der ersten Zelle (präsynaptisch) mit denen der zweiten (postsynaptisch) ergänzen und die Signalwege auf beiden Seiten der Synapse verändern können. Ein solcher Kommunikationsapparat besteht unter anderem aus Eph-Rezeptoren, die Trk-Rezeptoren der Neurotrophine Tyrosinkinasen sind und aus Ephrin-Liganden. Die Ephrine weisen hierbei zwei Besonderheiten auf, zum einen sind sie an die Zellmembran gebunden, zum anderen können sie, ebenso wie die Rezeptoren, Signalkaskaden in der Zelle regulieren. Es handelt sich hierbei um zwei große Proteinfamilien, die in Unterklassen A und B unterteilt werden. EphrinA-Liganden interagieren nur mit EphA-Rezeptoren, während EphrinB-Liganden neben EphB-Rezeptoren auch mit EphA4-Rezeptoren wechselwirken.
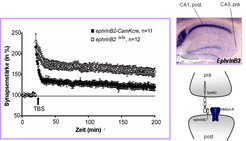
Bisher war bekannt, dass präsynaptische Ephrine an postsynaptische Eph-Rezeptoren binden und dadurch weitere intrazelluläre Signale auslösen. Jetzt konnten wir, in Zusammenarbeit mit der Arbeitsgruppe von Michael Frotscher, Freiburg, durch elektrophysiologische Messungen und elektronenmikroskopische Methoden nachweisen, dass Ephrine in bestimmten Nervenzellen des Hippokampus viel häufiger postsynaptisch als präsynaptisch vorkommen. Im nächsten Schritt haben wir untersucht, ob postsynaptische Ephrine an der Plastizität von Synapsen beteiligt sind und zwar sowohl an der Verstärkung (LTP), als auch an der Abschwächung oder Hemmung der synaptischen Effektivität, einer Langzeitdepression (LTD), auftreten. Unsere Ergebnisse mit verschiedenen transgenen Mauslinien ergab nun, dass zwei EphrinB-Liganden in der postsynaptischen Membran für die Ausbildung von LTP und LTD notwendig sind, was darauf hindeutet, dass so unterschiedliche Prozesse wie LTP und LTD konvergierende Signalwege in Neuronen auf unterschiedliche Weise beeinflussen.

Im letzten Schritt unserer Studie wollten wir die Rolle des EphA4-Rezeptors untersuchen, der im Hippocampus sehr stark exprimiert ist und sowohl Ephrine der Gruppe A wie B binden kann. Wir stellten dabei fest, dass der EphA4-Rezeptor zwar an der Ausbildung einer LTP und LTD beteiligt ist, die aktive Signalkaskade jedoch von den Ephrinen ausgehen muss, da auch mit einem seines "Signalisierungsteils" beraubten EphA4-Rezeptors die Verstärkung möglich war. In diesem speziellen Fall sind die Rollen also vertauscht: Der EphA4-Rezeptor verhält sich wie ein Signalgeber, während der EphrinB-Ligand die Signalübermittlung übernimmt. Etwas Vergleichbares hatten wir bereits in einer vorgehenden Studie für den EphB2-Rezeptor gefunden. Durch die Entdeckung, dass das EphrinB-Eph-Rezeptor-System in verschiedenen Hippokampus-Regionen in entgegen gesetzter Weise operiert, ergeben sich neue Möglichkeiten, wie die synaptische Plastizität im Gehirn zustande kommen könnte. Weitere Untersuchungen werden zeigen, wie dies im Detail erfolgt. Die Tatsache, dass ein Protein einmal als Signalgeber und einmal als Signalübermittler fungieren kann, lässt jedenfalls vermuten, dass auch andere Synapsen-Proteine auf diese Weise die Flexibilität einer Synapse, sich entsprechend der neuronalen Aktivität zu verändern, erweitern könnten.