Der Ursprung der Nervenzelldiversität
Developmental diversification of interneurons
Forschungsbericht (importiert) 2019 - Max-Planck-Institut für Neurobiologie
Einleitung
Die Nervenzellen im Gehirn von Säugetieren unterscheiden sich morphologisch, elektrophysiologisch und funktionell voneinander und lassen sich so in Hunderte verschiedene Zellpopulationen unterteilen. Jede Nervenzelle, auch Neuron genannt, besitzt im Zellkern sämtliche Gene des Erbguts, aber lediglich ein kleiner Teil davon wird exprimiert, also aktiv abgelesen. Diese sogenannten Genexpressionsmuster sind für jeden Zelltyp genau reguliert und definieren die morphologische und funktionelle Vielfalt. Wie und wann die unterschiedlichen Zelltypen während der Gehirnentwicklung entstehen und welche Faktoren die Entstehung spezifischer Genexpressionsmuster beeinflussen, ist wenig bekannt. Gerade das Säugetiergehirn besitzt ein hohes Maß an Flexibilität bei der Anpassung an die Umwelt, und vieles deutet darauf hin, dass ein komplexes Zusammenwirken von genetischen Faktoren und Umwelteinflüssen eine große Rolle bei der Diversifizierung spielt. Die Mechanismen, die solch ein Zusammenspiel zwischen Umweltfaktoren und Genexpression ermöglichen könnten, sind bislang weitgehend unbekannt.
Die Entwicklung kortikaler Interneurone
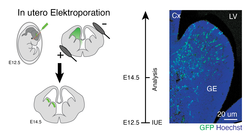
Eine besonders große Vielfalt gibt es bei GABAergen Interneuronen. Hierbei handelt es sich um hemmende Nervenzellen des Zentralnervensystems, die innerhalb eines lokal begrenzten Bereiches andere Nervenzellen miteinander verschalten. Sie ermöglichen so die Bildung von hoch spezialisierten Nervenzellnetzwerken. Eine umfangreiche Studie des Allen Brain Institute identifizierte allein im Neokortex von Mäusen 61 unterschiedliche Interneuronentypen [1].
All diese Zelltypen entstehen während der Embryogenese im medialen und kaudalen Bereich der sogenannten Ganglieneminenz (medial ganglionic eminence, MGE und caudal ganglionic eminence, CGE). Von hier aus wandern die Zellen in verschiedene Regionen des Frontalhirns, wo sie sich mit anderen Neuronen zu Netzwerken verknüpfen. Interessanterweise entstehen in jedem Bereich der Ganglieneminenz ganz unterschiedliche Interneuronentypen. So werden zum Beispiel Chandelier- und Basket-Interneurone im MGE gebildet, wohingegen Bipolar- und Bitufted-Interneurone aus dem CGE hervorgehen. Im Gegensatz zu den ausgereiften Interneuronen können die embryonalen Vorläuferzellen dieser Zelltypen in der Ganglieneminenz jedoch nicht anhand der Zellmorphologie unterschieden werden. Dies macht ihre Erforschung sehr schwierig.
Um Vorläuferzellen dennoch unterscheiden und gezielt untersuchen zu können, setzen die Forscher moderne RNA-Sequenzierungsmethoden ein und kombinieren diese mit klassischen Verfahren zur Bestimmung klonaler Abstammungslinien. Denn obwohl Vorläuferzellen in den Ganglieneminenzen optisch nicht unterscheidbar sind, besitzen sie bereits spezifische Genexpressionsmuster. Diese können mit hoher Präzision bestimmt und Vorläuferzellen so den entsprechenden reifen Zelltypen zugeordnet werden.
In der Praxis werden hierzu RNA-Moleküle der einzelnen Vorläuferzellen mit Hilfe einer mikrofluidischen Apparatur mit zellspezifischen Barcodes markiert. Anschließend wird aus der markierten RNA eine cDNA Bibliothek erzeugt, die mittels Next-Generation-Sequenziermethoden sequenziert wird. Die zellspezifischen Barcodes ermöglichen dabei das gleichzeitige Sequenzieren tausender Zellen, ohne die Zugehörigkeit von RNA-Molekülen zur jeweiligen Zelle zu verlieren. Auf diesem Weg können Einzelzelltranskriptionsprofile erstellt werden – also ermittelt werden, ob und wie stark jedes einzelne Gen pro Zelle aktiv ist.
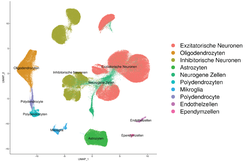
In einer 2018 in der Fachzeitschrift Nature veröffentlichten Studie [2] sammelten die Forscher Vorläuferzellen in unterschiedlichen Entwicklungsstadien und erstellten jeweils Einzelzell-Transkriptionsprofile. Die Ergebnisse zeigten, dass sämtliche Klassen der untersuchten Interneurone bereits in den Ganglieneminenzen ausgeprägt werden, bevor die heranreifenden Nervenzellen in andere Gehirnbereiche wandern. Die Befunde werfen ein neues Licht auf die molekulare Diversifizierung von Vorläuferzellen, wobei die Erkenntnisse auch klinische Relevanz haben könnten. So ergab eine detaillierte Betrachtung der zugrundeliegenden Genmodule zum Beispiel, dass der mit neuropsychiatrischen und neurologischen Entwicklungsstörungen in Verbindung stehende Transkriptionsenhancer Mef2c [3] eine entscheidende Rolle bei der Entwicklung von Basket-Interneuronen spielt.
Ausblick
Als nächstes will das Forscherteam die Annahme untersuchen, dass Vorläuferzellen in den Ganglieneminenzen nur ein begrenztes Spektrum neuronaler Typen hervorbringen können. Dieser Theorie zufolge wäre das Schicksal einer Zelle also eine Funktion ihrer Abstammungslinie; Neurone verschiedener Typen hätten unterschiedliche "Vorfahren". Im anderen Extremfall würden die Vorläuferzellen keine wesentlichen Informationen über den Typ der ausdifferenzierten Neurone liefern. Der Prozess der Differenzierung würde dann hauptsächlich von Wechselwirkungen mit anderen Zellen der Mikroumgebung abhängen. Das Markieren der Vorläuferzellen und ihrer direkten Abkömmlinge mit retroviralen DNA-Tags erlaubt es uns, dies zu testen. So können klonale Verwandtschaftsbeziehungen unterschiedlicher Zelltypen mit hoher Auflösung ermittelt werden.

