Designerproteine für die Hirnforschung
Forschungsbericht (importiert) 2018 - Max-Planck-Institut für Neurobiologie
Mittels sogenannter "gerichteter Evolution" lassen sich in vitro maßgeschneiderte Proteine für die neurobiologische Grundlagenforschung erstellen. Um solche Proteine effizienter erzeugen und validieren zu können, entwickelten wir eine Screening-Station, die es uns erlaubt, in Bakterien schnell und effizient besonders geeignete Protein-Varianten auszuwählen. Mit Hilfe dieser Station optimierten wir ein fluoreszierendes Protein, das sich besonders für das Markieren tief im Gehirn gelegener Strukturen eignet.
Einleitung
Proteine sind erstaunlich: optimiert durch Mutation und natürliche Auslese bilden sie die Kerne hoch komplexer Nanomaschinen, wie zum Beispiel spannungsabhängige Ionenkanäle, das katalytische Zentrum der Photosynthese, die Ribosomen, das Proteasom oder das fluoreszierende Protein GFP. Proteine übernehmen diverse strukturelle und regulatorische Funktionen, sowohl in einfachen Bakterienphagen als auch bei hoch entwickelten vielzelligen Organismen. In der Zelle werden nahezu alle Signaltransduktionen, die chemische Katalyse und ein Großteil der Regulation der Genexpression von Proteinen gesteuert. Wissenschaftler haben daher schon früh das ungeheure Potential erkannt, das maßgeschneiderte Designerproteine für Anwendungen in der Medizin und Biotechnologie oder als Werkzeuge für die neurobiologische Grundlagenforschung besitzen [1].
Proteine maßzuschneidern bedeutet, sowohl die existierenden Eigenschaften natürlicher Proteine zu verstärken, als auch solche mit völlig neuen Eigenschaften zu erzeugen. Die Herausforderungen dabei sind groß. Typischerweise sind in der Natur vorkommende Mutationsraten zu niedrig und operieren in zu langen Zeiträumen, als dass sie im Labor eingesetzt werden könnten. Deshalb arbeiten Wissenschaftler an immer besseren Mutagenese-Techniken, die im Labormaßstab nützlich sind.
Aus praktischen Gründen werden nicht die Proteine selbst diversifiziert. Stattdessen wird die dafür kodierende DNA mutagenisiert. Dafür steht inzwischen ein großes Arsenal an DNA-modifizierenden Enzymen und chemischen Methoden zur Verfügung. Bibliotheken mit diversifizierten DNA-Molekülen können jedoch außerordentlich groß werden. Die Herausforderung besteht daher darin, in solch großen Bibliotheken die Proteinvarianten zu identifizieren, die die gewünschten Eigenschaften besitzen. Je nachdem, welche Eigenschaften angestrebt werden, kann das recht einfach sein oder zu einer Suche nach der sprichwörtlichen "Nadel im Heuhaufen" werden. Auch die Anzahl an möglichen Varianten kann enorm sein. Wenn zum Beispiel nur ein kurzer Linker aus vier Aminosäuren diversifiziert wird, ergäbe das bei 20 unterschiedlichen Aminosäuren 160.000 hypothetische Kombinationen. Die völlige Diversifizierung eines fluoreszierenden Proteins wie EGFP (27 kD, 238 Aminosäuren lang) würde zu 20238 potentiellen Varianten führen. Es gäbe im gesamten Universum nicht genügend Kohlenstoff, um alle diese Varianten auch nur einmal herzustellen!
Ein ebenso wichtiger Faktor ist der biologische Kontext, in dem erzeugte Varianten validiert werden. In der Natur findet die Evolution von Proteinen eng gekoppelt an andere Proteine und Prozesse der Zelle statt. Im Labor erfolgt das Validieren von Proteinen dagegen meist in vitro, das heißt ohne Zellumgebung. Die Qualität und Aussagekraft eines Screens hängen demnach stark davon ab, ob die Wissenschaftler wenigstens teilweise in der Lage sind die notwendigen Bedingungen abzubilden, um die Eigenschaften von neuen Proteinvarianten zuverlässig einschätzen zu können. Natürlich sind zwischen der Anzahl getesteter Varianten und den möglichst realistischen physiologischen Bedingungen Kompromisse unvermeidlich. Wissenschaftler versuchen daher, beide Faktoren weiter zu optimieren.
Eine Imaging-Plattform zum Screenen von Proteinen
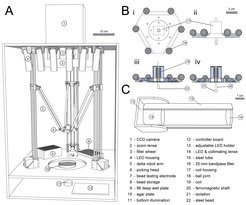
Abb. 1: Screening-Plattform für Protein-Optimierungen. A: Schema der Analyse-Station. Imaging mit einer CCD- Kamera (1) dient dazu, die Eigenschaften von Proteinvarianten zu analysieren, die in Bakterienkolonien auf Agar-Platten (10) exprimiert werden. Bis zu 1000 Bakterienkolonien pro Platte können so online validiert werden, wovon die besten Varianten mit dem Pick-Arm (6) für weitergehende Charakterisierungen ausgewählt werden können. Maßstab: 10 cm.
B: Schema des Pick-Arms, mit dem einzelne Bakterienkolonien ausgewählt werden. Er basiert auf einem Elektromagneten, mit dessen Hilfe ein kleines Stahlkügelchen kurz in eine Bakterienkolonie gedrückt wird und danach vom Arm zu einem Behälter mit Nähr-Medium transportiert wird, in das das Kügelchen mit daran haftenden Bakterien nach Abschalten des Magneten fällt. (i) Sicht von Oben; (ii) Sicht von der Seite, (iii) offene Seitenansicht mit aktivem Magneten und einem kleinen haftenden Kügelchen, (iv) offene Seitenansicht mit abgeschaltetem Magneten. Maßstab: 2 cm.
C: Schema der Anregungsvorrichtung mit integrierten LEDs.
Um die künstliche Entwicklung von Proteinen zu vereinfachen und auf ökonomische Weise möglichst viele Varianten eines Proteins zu validieren, entwickelte unser Forscherteam eine neuartige Screening-Station (Abb. 1). Diese basiert auf einem CCD-Kamera-System, das Weitfeld-Bilder von Agar-Platten mit Bakterienkolonien machen kann. Die flexible Fluoreszenz-Anregung durch eine Anordnung unterschiedlicher LEDs und eine Reihe von Emissionskanälen stellen sicher, dass die Plattform variabel eingesetzt werden kann. Auf diese Weise lassen sich Proteine bearbeiten, indem ihre Funktion an die Erzeugung eines Fluoreszenz-Signals gekoppelt wird. Das können fluoreszierende Proteine oder Biosensoren sein, aber indirekt auch Transkriptionsfaktoren, Proteasen und eine Reihe anderer Proteinklassen.
Auf den Agar-Platten können sich bis zu 1000 Bakterienkolonien befinden. Durch molekularbiologische Techniken wird vorher sichergestellt, dass jede Kolonie eine diversifizierte Variante eines Proteins exprimiert. Mit Hilfe einer Bildanalyse mit eigens dafür geschriebener Software kann jede einzelne Kolonie automatisch registriert und in ihren Fluoreszenzeigenschaften vermessen werden. So können aus Pools von mehr als 100.000 Bakterienkolonien die Kolonien identifiziert werden, die Proteine mit besonders gewünschten Eigenschaften exprimieren. Ein robotischer Arm hilft dann dabei, diese Kolonien zu ernten und damit Nährmedium anzuimpfen. Dadurch wird es möglich, größere Mengen von diesem bestimmten Protein herzustellen und genauer zu charakterisieren.
mCarmine: Ein tiefrot fluoreszierendes Protein
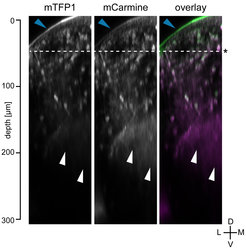
Abb. 2: Die Verwendung von mCarmine im lebenden Zebrafisch schafft höheren Kontrast. mCarmine und, als Vergleich, das helle grüne fluoreszierende Protein mTFP1 wurden in Nervenzellen von Zebrafischen exprimiert. Mittels konfokaler Mikroskopie wurden im Tier in beiden Kanälen Bilder aufgenommen (mTFP1: Anregung bei 442 nm; mCarmine: Anregung bei 633 nm). Je tiefer die Lage der untersuchten Struktur im Gehirn, desto schwieriger wird es, mit dem grünen mTFP1 detailreiche Bilder zu erzeugen. Mit mCarmine ist dies dagegen gut möglich (weiße Pfeilspitzen). Die Autofluoreszenz ist im grünen Kanalebenfalls deutlich höher, vor allem in der Haut des Fisches (blaue Pfeilspitzen). D: dorsal, V: ventral, L: lateral, M: mittig.
Fluoreszierende Proteine kommen in der neurobiologischen Forschung häufig zum Einsatz, um zum Beispiel Zellen im lebenden Gehirn zu markieren oder um subzelluläre Strukturen, wie zum Beispiel Synapsen, sichtbar zu machen. Aufgrund der Autofluoreszenz sowie der Licht streuenden und - absorbierenden Eigenschaften biologischer Gewebe ist es günstiger, wenn die eingesetzten Proteine weit im Roten fluoreszieren, denn in diesen Wellenlängenbereichen sind die Gewebe für Licht transparenter.
Mit Hilfe unserer Screening-Plattform konnten wir ein neues Protein entwickeln, das Licht vom tiefroten bis zum Nah-Infrarot-Bereich emittiert. Aus einem Dutzend Zyklen aus Mutagenese und Selektion, in denen einige hunderttausend Varianten analysiert wurden, entstand das neue Protein mCarmine [2]. Das Protein hat sein Anregungsmaximum bei 603nm und emittiert bis 675nm. Doch selbst nach 700nm ist die Emission noch nachweisbar. Dank dieser Eigenschaften können Wissenschaftler mit mCarmine tiefer in lebendes Gewebe hineinblicken als mit den bisher gängigen, hell-Grün emittierenden, fluoreszierenden Proteinen (Abb. 2). Da es zudem weniger Autofluoreszenz hervorruft, ermöglicht mCarmine eine kontrastreichere Fluoreszenzmarkierung für viele in vivo-Anwendungen. Zudem kann es die Basis für die Entwicklung einer Reihe von weit im Roten operierenden Biosensoren bilden.

