Arbeitsteilung im Fischgehirn – Wie eine Gruppe von Nervenzellen die Schwimmrichtung steuert
Forschungsbericht (importiert) 2013 - Max-Planck-Institut für Neurobiologie
Wie nimmt ein Tier seine Umwelt wahr? Und welche neurobiologischen Schaltkreise verarbeiten diese Informationen und steuern das Verhalten? Die Arbeitsgruppe um Herwig Baier in der Abteilung "Gene – Schaltkreise – Verhalten" am Max-Planck-Institut für Neurobiologie will diesen grundlegenden Fragen der Hirnforschung mit Hilfe eines kleinen Aquarienfisches auf die Spur kommen [1].
Der Zebrabärbling (Danio rerio), im Laborjargon Zebrafisch genannt, erweist sich für diese Fragestellungen als ausgezeichnetes Untersuchungsobjekt. Fische gehören ebenso wie der Mensch zur Gruppe der Wirbeltiere. Sie verfügen über einen anatomisch ähnlichen Gehirnaufbau, bringen jedoch den Vorteil mit sich, dass ihr Nervensystem kleiner und genetisch manipulierbar ist. Des Weiteren sind die Larven der Zebrafische transparent, was optischen Zugang zum Gehirn und damit den Einsatz neuer optischer Methoden der Hirnforschung erlaubt, so z. B. der "Optogenetik" und des Fluoreszenz-Imagings von Nervenzellaktivität [2; 3].
Optogenetik ermöglicht tiefe Einblicke in die neuronale Basis des Verhaltens
Bei der Optogenetik handelt es sich um ein relativ junges Fachgebiet, welches, wie der Name bereits andeutet, Licht einsetzt, um genetisch passgerecht veränderte Hirnareale experimentell zu beeinflussen. Hierbei werden genetisch kodierte Ionenkanäle in die Nervenzellen des Fisches eingebracht, die mit Licht angeschaltet werden können. Das prominenteste Beispiel ist der Kationenkanal Channelrhodopsin aus der Grünalge Chlamydomonas reinhardtii [4]. Dieser Kanal öffnet sich durch das Anstrahlen von blauem Licht, was zu einer Aktivierung der Nervenzelle führt. Damit lässt sich ein Neuron mit Licht anknipsen. Ähnliche optogenetische Methoden existieren, mit denen man ein Neuron mit Licht ausschalten kann [5].
Ergänzt wird die Optogenetik durch das sog. Kalzium-Imaging. Hierbei wird die Zelle nicht aktiviert, sondern ihre Aktivität gemessen. Dafür wird das Genom des Tieres so verändert, dass die Zellen einen Kalziumsensor herstellen. Der Sensor ist ein fluoreszierendes Protein, welches je nach Kalziumkonzentration der Zelle stärker oder schwächer leuchtet [6]. Da es in einem aktiven Neuron zum Einstrom von Kalzium kommt, kann nun mittels eines Mikroskops die Aktivität von Nervenzellen sichtbar gemacht werden.
Die Entwicklung dieser Schlüsselmethoden im vergangenen Jahrzehnt kam für die Neurobiologie einer Revolution gleich, da es nun möglich wurde, Nervenzellen zu manipulieren und deren Funktionen abzubilden. Diese Versuche können am lebenden Tier und oft ohne Operationen ausgeführt werden. Vor allem in Verhaltensstudien ermöglichen optische Techniken den Wissenschaftlern daher nie dagewesene Einblicke in die zugrunde liegenden neurobiologischen Prozesse.
Die Steuerzentrale der Schwanzbewegungen
Neurobiologen versuchen schon lange herauszufinden, wie tierisches (und menschliches) Verhalten von neuronalen Netzwerken gesteuert wird. Ungeklärt ist dabei nach wie vor, ob das Gehirn eher dezentral organisiert ist, das heißt, ob das globale Zusammenspiel einer großen Anzahl von Neuronen ein bestimmtes Verhaltensmuster bestimmt. In diesem Fall könnte einzelnen Nervenzellen keine genaue Funktion zugewiesen werden. Oder ist das Gehirn modular aufgebaut? In diesem Fall würden einzelne Bereiche bestimmte Kernkompetenzen besitzen, welche jeweils Komponenten eines Verhaltens beisteuern? Solche neuronalen Schaltkreis-Module könnten dann in verschiedener Art und Weise kombiniert werden und Einfluss auf eine Reihe unterschiedlicher Verhaltensantworten nehmen. Eine extreme Variante dieser Modul-Idee ist, dass jedes mögliche Verhalten von einem einzelnen hochspezialisierten neuronalen Schaltkreis kontrolliert wird.
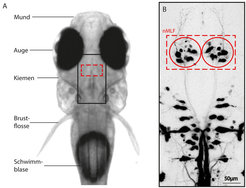
Die Retikulärformation im Gehirn von Zebrafischlarven stellt ein optimales Untersuchungsobjekt dar, um diese Frage zu beantworten (Abb. 1A, B). Die Nervenzellen stehen im direkten Kontakt zu Motorneuronen im Rückenmark des Fisches, können also einen direkten Einfluss auf die Schwanzbewegung nehmen [7]. Die absteigende (ins Rückenmark projizierende) Retikulärformation bildet somit eine Art Steuerungszentrale für die Schwanzbewegungen. Gibt es also einzelne Hebel in diesem Cockpit, mit denen die Schwanzbewegung gesteuert werden kann? Der Lösung sind die Wissenschaftler nun mittels mehrerer Experimente auf die Spur gekommen [2].
Licht ins Dunkel bringen – Genetische Lokalisierung eines möglichen Steuermoduls
Die Wissenschaftler nutzen für ihre Versuche transgene Fische [8], in denen eine kleine Zahl von Nervenzellen der Retikulärformation markiert ist. Unter diesen Nervenzellen befinden sich unter anderem mehr als 80 Prozent der Zellen eines Gehirnkerns, der nMLF genannt wird (Abb. 1B). Sie erhalten Information von visuellen Gehirnarealen, in die vom Auge Sinnesinformationen eingespeist werden, und kontaktieren motorische Nervennetzwerke entlang des Rückenmarks. Die ideale Grundlage zur Untersuchung der Arbeitsweise der Retikulärformation!
Zur Erforschung dieses potenziellen Moduls griffen die Wissenschaftler tief in die genetische Trickkiste, um die Nervenzellen des nMLF gezielt mit verschiedenen "Effektoren" zur optogenetischen Stimulation und Aktivitätsmessung auszustatten.
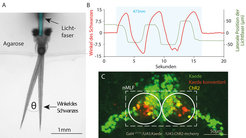
Was ist die Funktion der Neurone des nMLF? Um dies herauszufinden, beobachteten die Forscher die neuronale Aktivität im sich bewegenden Fisch. Dazu werden fünf Tage alte Larven, welche den Kalziumsensor in den markierten Nervenzellen enthalten, vorsichtig am Kopf fixiert, wobei sich der Schwanz noch immer frei bewegen kann (Abb. 2A). Nun kann man Schwimmbewegungen wie Vorwärtsschwimmen oder Drehungen beobachten und gleichzeitig die Aktivität der einzelnen Zellen messen.
Diese Experimente ergaben, dass viele Zellen des nMLF scheinbar bei jeder dieser ausgeführten Bewegungen aktiv sind. Ist der nMLF also ein multifunktionales Zentrum und Teil eines dezentralisierten Kontrollsystems?
Lichtschalter im Gehirn – Optogenetische Aktvierung von wenigen Nervenzellen steuert die Schwanzauslenkung
Um diese Fragen zu klären, ist es nicht ausreichend, Nervenzellaktivität zu messen. Man muss sie auch von außen stören und dann eine Verhaltensänderung messen. Also wurde ein weiterer "Effektor" ins Spiel gebracht, das Channelrhodopsin. Damit konnten nun die Zellen gezielt mit blauem Licht aktiviert werden, um somit ihren Beitrag zu den verschiedenen Schwimmbewegungen zu bestimmen. Erneut wurde der Fisch am Kopf fixiert, um dann mittels einer feinen Lichtfaser punktgenau Nervenzellen ansteuern zu können (Abb. 2A). Die Wissenschaftler konnten somit einzelne Neurone anschalten und das erzeugte Verhalten des Fisches beobachten.
Diese Experimente zeichneten nun ein ganz neues Bild der nMLF-Funktion. Zwar konnten durch die Stimulation der Neurone durchaus viele verschiedene Bewegungsmuster erzeugt werden, jedoch zeigten die Fische durchgehend eine ganz bestimmte Reaktion: eine starre Auslenkung des Schwanzes um bis zu 15° (Abb. 2A). Lässt man die Lichtfaser zwischen den beiden symmetrischen Kernen des nMLF gleiten, folgt der Schwanz der Position der Lichtfaser, wie ein Hund an der Leine (Abb. 2B). Der Schwanz des Fisches kann also mit Licht ferngesteuert werden!
Um die aktivierten Neurone zu identifizieren, bringt man ein weiteres Protein in die Zellen ein. Das fluoreszierende Protein Kaede, das mit Hilfe von UV-Licht von grün in rot umgewandelt werden kann [9]. Somit kann man die aktivierten Neurone genauestens lokalisieren (Abb. 2C). Sind diese Zellen also doch spezialisiert auf die Auslenkung des Schwanzes?
Demaskierung der Zellfunktion – Wie Laserstrahlen die Funktion der Nervenzellen preisgeben
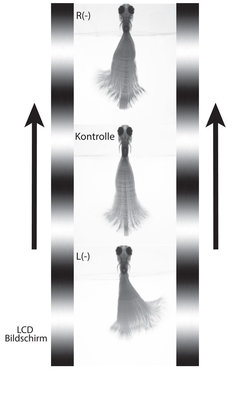
Welche Rolle haben nun diese Nervenzellen? Stellen sie ein multifunktionales Kontrollzentrum dar oder vermitteln sie nur die Auslenkung des Schwanzes? Ein weiteres Experiment brachte den Durchbruch. Mittels eines sehr fokussierten Laserstrahls können einzelne Neurone entfernt werden – eine sogenannte Laserablation [10]. Entfernt man nun die nMLF-Neurone auf einer Seite des Fisches, so zeigt sich, dass prinzipiell alle Bewegungen normal ausgeführt werden können. Versucht der Fisch jedoch nach vorne zu schwimmen, so wird die Vorwärtsbewegung zur Seite verschoben. Der Schwanz schlägt vor allem in die Richtung der intakten Seite (Abb. 3; R(-): rechter nMLF entfernt; L(-): linker nMLF entfernt). Möchte der Fisch also geradeaus schwimmen, wird er ungewollt in eine Kurve gezwungen.
Dies offenbarte den Forschern nun die wahre Aufgabe der Nervenzellen: Sie dienen wohl nicht der multifunktionalen Kontrolle von gesamten Bewegungsabläufen, sondern steuern in erster Linie die Haltung des Schwanzes während einer Schwimmbewegung. So sind diese Neurone zwar bei einer Vielzahl von Schwimmbewegungen aktiv, steuern jedoch nur einen Teil der Bewegung bei. Der nMLF scheint ein sehr spezialisiertes Modul in dem dezentralisierten Kontrollsystem des Schwimmapparats zu sein. Seine Neurone geben der Schwimmbewegung lediglich eine Richtung vor.
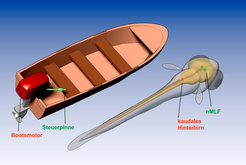
Zur Illustration soll auf eine Analogie zurückgegriffen werden. Ähnlich wie bei einem Motorboot, werden der Antrieb und die Steuerung von verschiedenen Komponenten übernommen. Der Bootsmotor, welcher den Propeller antreibt, bestimmt die Geschwindigkeit, wohingegen mittels der Steuerpinne das Boot gelenkt wird. Im Gehirn werden die Aufgaben sehr ähnlich verteilt. Frühere Arbeiten der Forscher um Herwig Baier haben eine kleine Region im kaudalen Hinterhirn entdeckt, die wie der Motor wirkt und den Fisch vorantreibt [5]. Der nMLF hingegen steuert die Schwimmrichtung (Abb. 4). Dies ist ein faszinierendes Beispiel dafür, wie die Aufgabenteilung des Gehirns bis auf die Ebene einzelner Nervenzellen funktioniert.
Ausblick
Die Entschlüsselung eines einzelnen Steuerzentrums bringt der Forschung einen weiteren Mosaikstein für den Zusammenbau eines Gesamtbildes der Gehirnfunktion. Es fehlen zwar noch viele solcher Steine für ein umfassendes Verständnis, wie Sinneseindrücke im Nervensystem unterschiedlichste Verhaltensmuster generieren. Aber die Entwicklung neuer genetischer Werkzeuge und der technische Fortschritt in der Mikroskopie ermöglichen schon jetzt detaillierte Einblicke in den Aufbau und die Funktion von neuronalen Schaltkreisen.
Die Autoren danken Anna Kramer und Anne Cerny für das Korrekturlesen, Robert Schorner für Abbildung 4, und den Mitgliedern des Baier-Labors für viele hilfreiche Diskussionen.
![Abb. 1: Neuroanatomie im Zebrafisch. A) Bild der Kopfregion einer 5 Tage alten Zebrafischlarve. Das schwarze Rechteck zeigt die Region der Retikulärformation, das rote die Region des nMLF, ein Mittelhirnkern für motorische Kontrolle. B) Mit einem Farbstoff gefüllte Zellen der absteigenden Retikulärformation, darunter die symmetrisch verteilten nMLF-Neurone (rote Kreise), offenbaren die Morphologie und Anordnung dieser Struktur [2]. Abb. 1: Neuroanatomie im Zebrafisch. A) Bild der Kopfregion einer 5 Tage alten Zebrafischlarve. Das schwarze Rechteck zeigt die Region der Retikulärfo](https://www.mpg.de/11601067/original-1508156955.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE2MDEwNjd9--dc25e8a8501e873f66384a5e54c85f12fa61d981)
![Abb. 2: Optogenetische Manipulation im Fischgehirn. A) Versuchsaufbau für optogenetische Experimente. Der Fischkopf wird in Agarose eingebettet und somit fixiert, wohingegen der Schwanz frei beweglich bleibt. Die Lichtfaser kann frei über dem Fisch bewegt werden. B) Aufzeichnung der Schwanzbewegungen während der optogenetischen Aktivierung. Wenn die Lichtfaser von links nach rechts bewegt wird (grün), folgt der Schwanz exakt dieser Bewegung (rot). C) Die aktivierten Neurone (rote Zellen) können mittels des Proteins Kaede genau lokalisiert werden [2]. Abb. 2: Optogenetische Manipulation im Fischgehirn. A) Versuchsaufbau für optogenetische Experimente. Der Fischkopf wird in Agarose eingebettet und so](https://www.mpg.de/11601075/original-1508156956.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE2MDEwNzV9--5a362ae3bfe5c2dcedaa06298715b4a9180b7677)
![Abb. 3: Laserablation der nMLF-Zellen; Versuchsaufbau für die Verhaltensexperimente. Einzelne Bilder eines Videos wurden übereinandergelegt, um die Bewegung der Schwanzflosse zu verdeutlichen. Ein LCD-Bildschirm zeigt nach vorne bewegte Streifenmuster, welche den Fisch dazu anregen, selbst nach vorne zu schwimmen. Entfernt man die Zellen des nMLF mittels eines Lasers, wird die eigentlich symmetrische Schwimmbewegung (Kontrolle) verzerrt (Ablation des linken L(-), bzw. rechten R(-) nMLF). Der Fisch würde beginnen, im Kreis zu schwimmen [2]. Abb. 3: Laserablation der nMLF-Zellen; Versuchsaufbau für die Verhaltensexperimente. Einzelne Bilder eines Videos wurden übereinandergelegt, um die Be](https://www.mpg.de/11601083/original-1508156956.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE2MDEwODN9--6c4f2778def74f3c744773c4fb279689102087cc)
