Leuchtproteine als Kundschafter in der Zelle
Forschungsbericht (importiert) 2012 - Max-Planck-Institut für Neurobiologie
Das grün fluoreszierende Protein GFP
Die Entdeckung des grün fluoreszierenden Proteins (GFP) ist ein wunderbares Beispiel dafür, dass Fortschritte in der Wissenschaft aus unerwarteten Richtungen kommen können und nicht unbedingt immer planbar sind. Die Entdeckung des GFP löste eine Forschungsrevolution aus. Bemerkenswerterweise hat diese ihren Ursprung jedoch nicht in einem Spitzenlabor eines High-Tech-Campus, sondern an einem abgeschiedenen Ort an der US-amerikanischen Pazifikküste (Abb. 1). Initiiert wurde sie zunächst von einem einzelnen Wissenschaftler: Osamu Shimomura, der 1962 GFP in der biolumineszenten Qualle Aequoria victoria entdeckte, wo das Protein eine wichtige molekulare Komponente des Leuchtorgans darstellt [1]. Die nachfolgende Klonierung des Gens für GFP durch Douglas Prasher [2] schaffte die Möglichkeit, bestimmte Zellen in einem Organismus zum Leuchten zu bringen. Das dahinterliegende Prinzip ist recht einfach: Die Wissenschaftler bringen das Gen, sozusagen die „Bauanleitung“ für GFP, durch Gentransfer in einen anderen Organismus ein. Dessen Zellen können daraufhin das GFP-Protein herstellen.

Im Laufe der letzten 15 Jahre kamen neue GFP-Farbvarianten durch gezielte Mutagenese der ursprünglichen GFP-DNA-Sequenz und die Entdeckung neuer GFP-artiger Proteine in Korallen und anderen Meeresorganismen hinzu. Mittlerweile steht den Wissenschaftlern ein volles Farbspektrum an Leuchtproteinen zur Verfügung. In der heutigen biomedizinischen Forschung sind diese Proteine zum universalen Werkzeug avanciert, mit dem Zellen und Strukturen in lebenden Tieren, Pflanzen, Pilzen und Bakterien sichtbar werden.
Wie aus einem Leuchtprotein ein Sensor wird
Leuchtproteine fluoreszieren und bringen so eine Zelle oder Zellbestandteile zum Leuchten. Damit aus ihnen jedoch ein Sensor für biologische Vorgänge wird, muss es eine messbare Veränderung in der Fluoreszenz geben. Der zu untersuchende Prozess in der Zelle sollte also die Fluoreszenz des Leuchtproteins modulieren. Beispielsweise könnte ein ausgeschütteter Botenstoff als Ligand (Bindungspartner) an den Sensor binden und so dessen Fluoreszenzeigenschaften verändern. Diese Änderung kann kalibriert und optisch mit modernen Mikroskopiermethoden in lebenden Zellen gemessen werden. Einige Leuchtproteinvarianten aus der Qualle Aequoria sind pH-sensitiv oder werden durch Bindung von Chlorid-Ionen in ihren Fluoreszenzeigenschaften moduliert. Diese Eigenschaften können genutzt werden, um zum Beispiel die pH-Regulierung in zellulären Organellen zu untersuchen oder Fluktuationen der zellulären Chloridkonzentration zu messen. In den meisten Fällen ist es jedoch notwendig, die Leuchtproteine für den Prozess von Interesse „künstlich“ sensitiv zu machen. An der Entwicklung solcher Indikatorproteine arbeitet die Forschungsgruppe um Oliver Griesbeck am Max-Planck-Institut für Neurobiologie.
Indikatorproteine lassen sich auf verschiedene Weise herstellen. Eine besonders elegante und sehr universell einsetzbare Möglichkeit besteht darin, Förster-Resonanz-Energie-Transfer (FRET) zwischen geeigneten GFP-Varianten zu verwenden, um ein auslesbares Fluoreszenzsignal zu erzeugen. FRET ist ein spektroskopisches und quantenmechanisches Phänomen, bei dem unter bestimmten Umständen Teile der Energie eines angeregten Fluorophores (des Donors) strahlungsfrei auf ein anderes Fluorophor (den Akzeptor) übertragen werden [3]. In der Praxis wird dazu der Donor mit Licht einer geeigneten Wellenlänge selektiv angeregt. Dieser sendet daraufhin sein Licht mit einem ihm charakteristischen Emissionsspektrum aus. Befindet sich ein Akzeptor in der Nähe, so erhöht sich der Energietransfer vom Donor zum Akzeptor. Als Folge wird weniger Licht im Spektrum des Donors, dafür vermehrt Licht vom Akzeptor mit den für ihn charakteristischen spektralen Eigenschaften ausgesendet. Quantitativ wird die Effizienz dieses Energietransfers durch die Förster-Gleichung beschrieben. Neben einer Reihe von anderen Parametern spielen dabei der Abstand und die Orientierung der Fluorophore zueinander eine wichtige Rolle. Ist ein Sensor so entwickelt, dass ein Akzeptor im Laufe eines biologischen Vorgangs in die Nähe eines Donors kommt, so gibt es einen sichtbaren Wechsel der Fluoreszenzfarbe.
Zur Messung eines biologischen Prozesses kann auch eine Liganden-bindende Domäne zwischen zwei FRET-geeignete GFP-Varianten eingebracht werden. Der Sensor ist so konstruiert, dass nach Bindung eines Liganden die Domäne ihre Gestalt ändert. Dies führt dazu, dass sich sowohl die Entfernung als auch die Orientierung der beiden GFPs zueinander ändern. Hierdurch ändert sich auch die Effizienz des Energietransfers vom Donor-GFP zum Akzeptor-GFP.
In der Natur werden molekulare Prozesse häufig durch die Gestaltänderung von Proteindomänen gesteuert. Somit können mit der beschriebenen Methode zahlreiche intrazelluläre Mechanismen sichtbar gemacht werden.
Das erste Sensorprotein, das auf diese Weise hergestellt wurde, war ein Kalziumsensor [4]. Kalzium-regulierte Prozesse spielen in der Biologie eine ungemein wichtige Rolle. Unter anderem sind sie an zahlreichen physiologischen Prozessen auf sehr unterschiedlichen Zeitskalen beteiligt – von der Regulation der Sekretion von Peptiden, Hormonen und Neurotransmittern bis hin zur Expression bestimmter Gene. In den Neurowissenschaften kann das optische Messen von intrazellulären Kalziumfluktuationen als Ersatz für das Messen neuronaler Aktivität mittels Elektroden verwendet werden.

Es ist kein Wunder, dass das Interesse an einer weiteren Verbesserung dieser Sensoren groß ist. Neuere Kalziumsensoren wie TN-XXL oder Twitch-1 benutzen das Kalzium-bindende Protein Troponin C – das Protein, das im Skelett- und Herzmuskel Kontraktion reguliert – als Sensordomäne (Abb. 2A) [5, 6, 7]. Die Struktur des Sensors TN-XXL, aufgeklärt mittels SAXS (Small Angle X-Ray Scattering) (Abb. 2B und 2C), zeigt anschaulich, wie ein FRET-Sensorprotein funktioniert [8]: Ohne Kalzium ist das Protein ein ausgestrecktes Stäbchen, bei dem die beiden GFPs an den jeweiligen Enden sitzen und maximal voneinander entfernt sind. Durch die Gestaltänderung der Kalzium-bindenden Domäne wird das Protein fast kugelförmig und die beiden GFPs werden wahrscheinlich nahe und optimal zueinander orientiert, um eine hohe FRET-Effizienz zu gewährleisten. Durch solche Untersuchungen der strukturellen und biophysikalischen Eigenschaften lernen Forscher, wie diese Biosensoren im Detail auf molekularer Ebene funktionieren und wo es Ansatzpunkte für weitere Verbesserungen gibt.
Dem Immunsystem bei der Arbeit zusehen
Das Immunsystem überwacht den Körper und bekämpft eindringende Viren, Bakterien und andere Krankheitserreger. Wenn die Erkennung von Freund und Feind jedoch nicht präzise funktioniert, dann können Komponenten des Immunsystems den eigenen Körper attackieren und schwere Autoimmunkrankheiten auslösen. Ein Beispiel solch einer Autoimmunerkrankung ist die Multiple Sklerose. Hier stehen bestimmte Abwehrzellen, die T-Lymphozyten, im Zentrum des Geschehens. Diese T-Zellen infiltrieren das zentrale Nervensystem und greifen Komponenten der Myelinschicht um die Nervenbahnen an. Zuvor müssen die T-Zellen jedoch aktiviert werden. In ihrer Lebenszeit durchwandern sie eine Reihe von Körpergeweben und kommen in Kontakt mit unterschiedlichen Zelltypen. Durch diese Kontakte können T-Lymphozyten durch bisher noch unbekannte Signale instruiert werden, ihre Eigenschaften zu verändern. Diese Kommunikation zwischen den Zelltypen ist in den meisten Fällen von komplexen intrazellulären Kalziumsignalen begleitet.
Die Aktivierung des T-Zell-Rezeptors mobilisiert die Kalziumfreisetzung aus intrazellulären Speichern. Das führt wiederum zum Öffnen weiterer Kalziumkanäle in der Zellmembran, durch die verstärkt Kalzium in die Zelle einfließen kann. Letztendlich kann dies zu einer signifikanten Erhöhung der Kalziumkonzentration innerhalb der Zelle führen. Langfristig verändert der erhöhte Kalziumspiegel in aktivierten T–Zellen auch das Genexpressionsmuster.
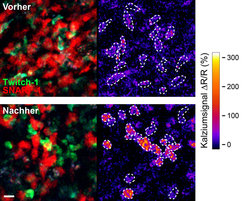
Mit Hilfe der verbesserten Kalziumsensoren werden diese Veränderungen nun erstmals im lebenden Gewebe unter dem Mikroskop sichtbar. Durch die Beobachtung der Kalziumsignale in autoaggressiven T-Lymphozyten bei ihrer Wanderung im Gewebe erhoffen sich die Wissenschaftler Aufschluss darüber, mit welchen Zellen die T-Zellen interagieren und kommunizieren und wo fehlerhafte Aktivierungen stattfinden. So könnten die Auslöser gefunden werden, die schließlich zu den fatalen Immunreaktionen gegen den eigenen Körper führen. Um dies zu realisieren, benutzten Forscher des Max-Planck-Instituts für Neurobiologie in den hoch beweglichen T-Zellen genetisch kodierte FRET-Kalziumsensoren wie TN-XXL oder Twitch-1 [6]. Die Studie hat gezeigt, dass auf diese Weise die Kalziumsignale der T-Zellen in Lymphknoten (Abb. 3) und im Gehirn von lebenden Mäusen studiert werden können. Die Hoffnung der Wissenschaftler ist es, Schritt für Schritt mehr über die Physiologie dieser aggressiven Zellen im lebenden Organismus zu lernen – ein wichtiger Ansatz für die spätere Entwicklung von Therapien.

![Abb. 2: Schema und Struktur. Zu sehen ist ein Schema des Kalzium-Biosensors TN-XXL (A) und eine Struktur des Sensorproteins, die durch die niedrig auflösende Technik SAXS (Small Angle X-Ray Scattering) erhalten wurde (B, C). Die GFPs, die als Donor (eCFP) und Akzeptor (cpCit) fungieren, sind an die Enden des Kalzium-bindenden Proteins Troponin C fusioniert (A, C). Kalziumbindung an Troponin C erhöht den FRET vom Donor eCFP zum Akzeptor cpCit. Die SAXS-Strukur zeigt, dass das Sensorprotein im Kalzium-freien Zustand fast stäbchenförmig ausgestreckt ist, während es sich bei Kalziumbindung fast zu einer Kugelform verdichtet, in der die beiden GFPs wahrscheinlich eng aneinanderliegen, um optimalen Energietransfer zu gewährleisten (siehe auch [8]). Abb. 2: Schema und Struktur. Zu sehen ist ein Schema des Kalzium-Biosensors TN-XXL (A) und eine Struktur des Sensorproteins, die durch die niedrig auf](https://www.mpg.de/11591274/original-1508156519.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE1OTEyNzR9--b524ae4ef6f77b475460c5d3eb9eda35b973d1ec)
