Wegweiser für wachsende Nerven
Forschungsbericht (importiert) 2011 - Max-Planck-Institut für Neurobiologie
Unsere Bewegungen werden von Nervenzellen gesteuert, die sich im Rückenmark befinden. Vor der Geburt werden diese Zellen mit Muskeln verknüpft, die zum Teil weit vom Rückenmark entfernt liegen, wie zum Beispiel die Unterschenkelmuskeln. Dafür müssen die Ausläufer der Nervenzellen durch unterschiedliche Gewebearten zu ihrem Ziel wachsen. Wie finden sie den richtigen Weg in dieser komplexen Umgebung? Forscher des Max-Planck-Instituts für Neurobiologie untersuchen mithilfe von genetischen und zellbiologischen Methoden die molekularen Signale, die den wachsenden Nerven die Navigation erleichtern.
Das Nervensystem der Säugetiere besteht aus einer enormen Anzahl von Nervenzellen, die ständig miteinander kommunizieren müssen. Die Information wird in Form von elektrischen Impulsen über lange Zell-Ausläufer, sogenannte Axone, an andere Zellen weitergegeben. Die Nervenzellen können nicht nur mit ihren direkten Nachbarn verbunden sein, sondern auch mit Partnerzellen in weit entfernen Regionen. Fehlerhafte Verbindungen können zu massiven Störungen des Nervensystems führen. Um derartige Entwicklungsstörungen oder auch Verletzungen von Nerven in Zukunft besser behandeln zu können, müssen die zugrunde liegenden Mechanismen des Nervenwachstums erforscht werden. Wie werden also Verbindungen zwischen Nervenzellen und ihren Partnerzellen hergestellt?
Der Aufbau der Nerv-Muskel-Verbindungen
Während der Entwicklung orientieren sich wachsende Axone an chemischen Signalen in ihrer Umgebung. Diese Botenstoffe können anziehend sein und Axone in eine bestimmte Richtung locken, oder sie können abstoßend wirken und Axone von einer Stelle fernhalten. Die Mechanismen der axonalen Wegfindung lassen sich am Beispiel der Verbindungen zwischen Motoneuronen und Beinmuskeln gut untersuchen. Motoneuronen sind Nervenzellen, die Muskelbewegungen steuern. Im Rückenmark liegen die für das Bein zuständigen Motoneuronen nah beieinander, wobei die Zellen, die sich näher zur Mitte befinden, die inneren Unterschenkelmuskeln steuern, während die Zellen, die weiter außen liegen, die äußeren Unterschenkelmuskeln innervieren. Wenn die Ausläufer dieser zwei Gruppen von Nervenzellen das embryonale Rückenmark verlassen, wachsen sie zunächst zusammen in einem Bündel. Nachdem sie am Beinansatz angekommen sind, teilen sie sich in zwei Bahnen. Wie entscheiden die Axone, welche Bahn sie wählen sollen? Jedes Axon besitzt an seinem Ende einen Wachstumskegel, der sehr beweglich und mit einer Vielzahl von Rezeptoren ausgestattet ist. Die Rezeptoren wirken wie Antennen, die die molekularen Signale aus unterschiedlichen Richtungen aufspüren und ins Zellinnere weiterleiten.
Zusammenwirken von Signalen an Verzweigungsstellen
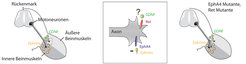
Um zu verstehen, welche Wirkungen die einzelnen Signale haben, untersuchen die Forscher Mäuse, bei denen bestimmte wegweisende Signale oder ihre Rezeptoren mit genetischen Methoden ausgeschaltet wurden. Anhand von Defekten, die diese Mäuse aufzeigen, kann man auf die Bedeutung der fehlenden Faktoren schließen. Zum Beispiel haben die Ausläufer, die zur Außenseite des Unterschenkels wachsen, den sogenannten EphA4-Rezeptor auf ihren Wachstumskegeln, mit dem sie eine Familie von abstoßenden Botenstoffen, die Ephrine, erkennen. Die Ephrine sind auf den Zelloberflächen der Innenseite des Unterschenkels vorhanden, verhindern das Einwachsen der mit EphA4 bestückten Axone und leiten sie somit in die äußere Bahn. Wenn EphA4 genetisch ausgeschaltet wird, nehmen die wachsenden Nerven das abstoßende Signal nicht mehr wahr und wählen oftmals die innere Bahn (Abb. 1). Die Forscher aus der Abteilung von Rüdiger Klein haben herausgefunden, dass ähnliche Defekte auftreten, wenn ein anderer Rezeptor fehlt, der sogenannte Ret-Rezeptor [1]. Das Signal, das von Ret erkannt wird, heißt GDNF und ist auf der äußeren Seite der Nervenverzweigung zu finden, also genau dort, wo die Axone im Normalfall hinwachsen (Abb. 1).
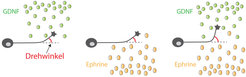
Diese Erkenntnisse warfen die Frage auf, wie GDNF genau auf Axone wirkt und wie es an dieser Stelle mit den Ephrinen zusammenwirkt. Um dies herauszufinden, haben die Forscher Motoneuronenkulturen mit GDNF und Ephrinen behandelt und sie mit Zeitraffermikroskopie beobachtet. Wenn GDNF den Motoneuronen von einer Seite präsentiert wurde, kam es vor, dass sich die Ausläufer zu dieser Seite drehten, was darauf hinweist, dass sie von GDNF angezogen wurden. Wenn sie von einer Seite mit Ephrinen konfrontiert wurden, kam es vor, dass sich die Axone in die Gegenrichtung drehten. Wenn nun beide Signale gleichzeitig aus entgegengesetzten Richtungen angeboten wurden (in der Art wie sie auch an der Verzweigungsstelle angeordnet sind), wurde der Drehwinkel der Axone deutlich größer (Abb. 2). Ephrine und GDNF scheinen also zusammenzuwirken, indem das eine Signal die Axone abstößt und das andere sie gleichzeitig von der gegenüberliegenden Seite anzieht [2].
Multitasking des EphA4-Proteins
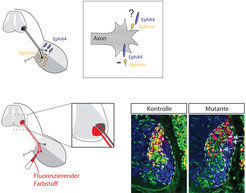
Ephrine sind nicht nur dazu da, den EphA4-Rezeptor anzuregen und eine Signalkaskade im Inneren der Wachstumskegel auszulösen. Ephrine, die auf den Zellen verankert sind, können nach Kontakt mit EphA4 selbst auch als Rezeptoren fungieren und eine Signalkaskade im Zellinneren auslösen. Bemerkenswerterweise ist EphA4 nicht nur auf den wachsenden Nerven, sondern auch in der äußeren Hälfte des Beines zu finden, und die Ephrine kommen nicht nur im Bein, sondern auch auf den Wachstumskegeln vor (Abb. 3).
Könnte EphA4 neben seiner Funktion als Rezeptor auch noch als Signal für die mit Ephrinen ausgestatteten Axone wirken? Bisher konnte man diese Frage nicht im lebenden Organismus beantworten, weil das Ausschalten des EphA4-Gens im gesamten Körper sowohl die Funktion im Wachstumskegel als auch im Zielgewebe des Beines verhindert. Um zwischen den Funktionen dieses Moleküls an den zwei Stellen zu unterscheiden, haben die Max-Planck-Forscher nun mithilfe moderner genetischer Methoden Mauslinien hergestellt, in denen EphA4 entweder nur im Nervensystem oder nur im Bein oder an beiden Stellen fehlt. Je wichtiger die Bedeutung des Moleküls an einer bestimmten Stelle, desto mehr fehlgeleitete Nervenfasern wird man in den Mäusen finden, bei denen das Molekül an der jeweiligen Stelle fehlt.
Um die Axone zu erkennen, die auf die innere Beinseite fehlgeleitet wurden, injiziert man in diese Seite einen fluoreszierenden Farbstoff, der von den Axonen aufgenommen wird und zu den Zellkörpern im Rückenmark diffundiert. Wenn sich die „äußeren“ Axone auf der inneren Seite befinden, wird der Farbstoff im Rückenmark an der falschen Stelle ankommen, das heißt Zellen an der falschen Stelle aufleuchten lassen (Abb. 3). In den Tieren, bei denen EphA4 sowohl im Nervensystem als auch im Bein fehlte, wurden sehr viele Nervenfasern fehlgeleitet. Die Mäuse, bei denen EphA4 selektiv in den Nervenzellen ausgeschaltet war, wiesen dagegen erheblich weniger fehlgeleitete Axone auf. Das vorhandene EphA4 im Bein reichte also aus, um eine beträchtliche Anzahl von Fasern in die richtige Bahn zu leiten. Diese Ergebnisse deuten darauf hin, dass EphA4 auf zwei unterschiedliche Weisen zur axonalen Wegfindung im Bein beiträgt, erstens als Rezeptor auf den Nervenfasern, der abstoßende Ephrine erkennt, und zweitens als Signal im Beingewebe, das die mit Ephrin-ausgestatteten Nervenfasern anlockt und somit in die äußere Bahn lenkt.
Trotz der neuen Einblicke in die Wirkungsweise einiger wichtiger Moleküle bleiben noch viele molekulare und zelluläre Vorgänge bei der Ausbildung von neuronalen Schaltkreisen ungeklärt. Weitere Forschungen auf dem Gebiet werden wichtige Grundlagen liefern, um neue Strategien zur Wiederherstellung der neuronalen Schaltkreise bei Krankheiten und Verletzungen zu entwickeln.


