Bewegungssehen im Fliegenhirn
Forschungsbericht (importiert) 2010 - Max-Planck-Institut für Neurobiologie
Fliegen sind faszinierende Flugkünstler: Geschickt schießt eine Stubenfliege mit zwei Metern pro Sekunde durch den Raum, um am Ende mit einer halben Rolle rückwärts an der Zimmerdecke zu landen. Anders als beim Menschen erfasst die Fliege die gesamte Welt auf einen Blick, denn ihre großen Facettenaugen gewähren einen 360°-Panoramablick. Optische Informationen verarbeitet die Fliege viel schneller als der Mensch. So würde eine Schmeißfliege einen Kinofilm mit 100 Bildern pro Sekunde noch als Einzelbilder erkennen, während der Mensch die dunklen Pausen bereits ab 24 Bildern pro Sekunde nicht mehr wahrnimmt. So kann die Fliege die rasant vorbeiziehende Umgebung zuverlässig erfassen und bewerten.
Diese äußerst effiziente Verarbeitung optischer Informationen im Fliegenhirn fasziniert Neurobiologen schon lange. Besonders attraktiv ist dabei, dass das Fliegengehirn vergleichsweise wenige Nervenzellen besitzt. Im Säugetiergehirn gibt es mehrere hundert Milliarden Nervenzellen, im Fliegengehirn sind es gerade einmal 100.000 Zellen. Die Aufgabe einzelner Nervenzellen und ihr Zusammenspiel im Netzwerk kann in der Fliege somit deutlich leichter untersucht werden. Die detaillierte Analyse solch eines überschaubaren Modellsystems ist ein wichtiger Schritt, um auch die Vorgänge in komplexeren Gehirnen zu verstehen.
Präzisionsarbeit auf kleinstem Raum

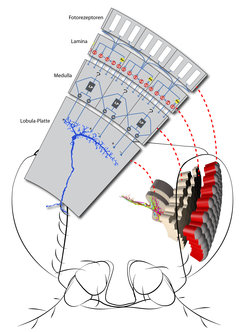
Alexander Borst und seine Mitarbeiter am Max-Planck-Institut für Neurobiologie in Martinsried haben es sich zum Ziel gesetzt, das Bewegungssehen der Fliegen zu entschlüsseln. Keine leichte Aufgabe, denn die vergleichsweise wenigen Zellen verteilen sich in der Schmeißfliege auf gerade einmal einen Kubikmillimeter Gehirn. Das zweite Untersuchungsobjekt, die Fruchtfliege Drosophila, ist insgesamt nur so groß wie das Gehirn einer Schmeißfliege. Um die Reaktionen und die Verschaltung der Nervenzellen im Gehirn dieser Fliegen zu untersuchen, zeigen die Wissenschaftler ihnen bewegte Streifenmuster auf einem Leuchtdioden-Bildschirm, der „LED-Arena“. Mit feinen Elektroden messen sie dann die elektrische Antwort einzelner Nervenzellen (Abb. 1). Auf diese Weise konnten die Vorhersagen mathematischer Modelle zum Bewegungssehen der Fliegen bestätigt werden. Wie die einzelnen Zellen jedoch genau miteinander verbunden sind, damit sie wie im Modell arbeiten, das blieb auch nach jahrelanger Forschung ein Rätsel – viele Nervenzellen sind einfach zu klein, um sie mithilfe von Elektroden zu untersuchen. Es musste ein Weg gefunden werden, die Aktivität dieser Nervenzellwinzlinge ohne Elektroden im reagierenden Gehirn zu beobachten.
Fluoreszenz-Moleküle und modernste Mikroskope
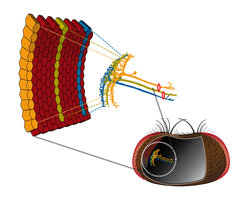
Diese Hürde nahmen die Martinsrieder Wissenschaftler vor knapp zwei Jahren [1]. Es gelang ihnen, Fruchtfliegen zu züchten, bei denen einzelne Nervenzellen mit dem Indikator-Molekül TN-XXL ausgestattet waren. Dieses Molekül, entwickelt von Oliver Griesbeck und seinem Team am MPI für Neurobiologie [2], ändert seine Fluoreszenz, wenn die Nervenzelle aktiv ist. Zusammen mit dem Zwei-Photonen-Mikroskop waren so endlich die technischen Möglichkeiten geschaffen, um den zellulären Aufbau des Bewegungsdetektors im Fliegenhirn zu untersuchen (Abb. 2).
Licht an und aus im Fliegenkino
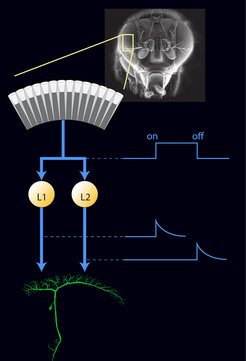
Mit diesen Methoden untersuchten die Martinsrieder Wissenschaftler zunächst die Aktivität der Lamina-Zellen. Bis dato gab es nur vage Vorstellungen, was diese Zellen machen – und warum sich gleich fünf Lamina-Zellen hinter jedem Fotorezeptor befinden. Für ihre Untersuchungen blockierten die Neurobiologen einzelne Lamina-Zellen mithilfe der Gentechnik und zeigten den Fliegen dann bewegte Streifenmuster. Die Fotorezeptoren des Auges nehmen die vorbeiziehenden Streifen als Hell-Dunkel- und Dunkel-Hell-Übergänge wahr. Wie erwartet maßen die Forscher am vorderen Ende der L2-Zelle, also in dem Zellteil, der die Informationen vom Fotorezeptor bekommt, ganz ähnliche Reaktionen wie im Fotorezeptor [3]. Überraschenderweise wurde diese Information dann jedoch von der L2-Zelle umgewandelt, denn die Zelle gibt nur noch Information über Helligkeitsabnahmen, also Hell-Dunkel-Übergänge („Licht-aus“) an nachfolgende Zellen weiter. Da die Fliege beide Kontrastübergänge wahrnimmt, musste es also noch andere Zellen geben, die Informationen zu Dunkel-Hell-Übergängen („Licht-an“) weiterleiten. Diesen Zelltyp aufzuspüren, war das nächste Projekt der Wissenschaftler. Die Suche nach diesem zweiten Zelltyp brachte erstaunliche Parallelen in der neuronalen Verarbeitung zwischen Fruchtfliegen und Wirbeltieren ans Licht. Bei Wirbeltieren beginnt die Verarbeitung von Bildern bereits in der Netzhaut der Augen. Hier spalten die Nervenzellen das Gesehene vor seiner Weitergabe an das Gehirn in Bilder mit unterschiedlichem Informationsgehalt auf. Tatsächlich passiert etwas ganz ähnliches auch im Fliegenhirn [4]. Direkt nach den Fotorezeptoren werden hier Informationen zu Kontraständerungen in zwei Bildkanäle aufgetrennt: Während die L2-Zelle nur „Licht-aus“-Informationen weitergibt, reagieren die den L1-Zellen nachgeschalteten Neurone nur bei „Licht-an“ (Abb. 3).
Energiesparen quer durchs Tierreich
Es ist erstaunlich, dass diese Aufspaltung von Kontrastinformation bei allen Wirbeltieren und jetzt auch bei Fliegen zu finden ist. Das deutet darauf hin, dass dieser Verarbeitungsweg schon früh in der Evolution entstanden ist. Das System sollte somit einen Vorteil haben, denn sonst wäre es längst wieder aus dem Bauplan der Tiere verschwunden. Die Max-Planck-Forscher vermuten, dass das Gehirn auf diese Weise Energie spart: Würde nur eine Zelle die Information über die verschiedenen Kontraständerungen weiterleiten, müsste sie eine Grundspannung halten, die sich bei „Licht an“ verstärkt und bei „Licht aus“ abschwächt. Solch eine Grundspannung kostet Energie. Zwei Zellen zu haben ist daher effizienter, denn sie brauchen jeweils nur dann aktiv zu werden, wenn „ihre“ Kontraständerung auftritt.
Robuste Modelle bei komplexer Umwelt
Neben den direkten Laboruntersuchungen stellen die Martinsrieder Neurobiologen die Zellreaktionen auch in Modellen nach. Ein neu entwickeltes Modell berücksichtigt für seine Vorhersagen zur Reaktion einer Nervenzelle sowohl die Funktion (Input/Output) als auch die biophysikalischen Eigenschaften der Zelle [5]. Dies ist eine wichtige Erweiterung, die zu einem deutlich besseren Verständnis der Interaktionen zwischen den Nervenzellen führt. Denn die bisherigen Modelle bezogen vor allem die Eingangs-Ausgangs-Beziehung der Nervenzellen mit ein. Was innerhalb der Zellen mit den Signalen passiert, spielte keine Rolle für die Vorhersagen. Dies ist jedoch ein wichtiger Teil der Informationsverarbeitung, und so versagten die herkömmlichen Modelle regelmäßig, wenn die vorgespielten Muster komplexer wurden.
In ihren Versuchen zeigten die Wissenschaftler den Fliegen anstatt der Streifenmuster bewegte Punktmuster mit verschiedener Punktdichte. Sie fanden heraus, dass die Nervenzellen bei hoher und niedriger Punktdichte grundsätzlich gleich reagieren. Das ist erstaunlich, denn bei wenigen Punkten erhält eine Nervenzelle deutlich weniger visuelle Bewegungsinformation als bei hoher Punktdichte. Offensichtlich gleichen die Zellen Unterschiede in den Eingangssignalen über einen internen Verstärker aus. Diese Signalverstärkung bezogen die Neurobiologen in ihre Berechnungen mit ein. Mit Erfolg, denn das neue Modell beschreibt sehr zuverlässig das Verhalten der Nervenzellen des Netzwerks, egal wie komplex die Welt um die Fliege herum ist.
Vielschichtige Schaltkreise
Wie wichtig die Vorgänge innerhalb einer Nervenzelle sind, zeigte auch eine andere Arbeit der Martinsrieder Wissenschaftler. Im Flugkontrollzentrum der Fliege, der Lobula-Platte, reagieren einzelne Zellgruppen auf bestimmte Bewegungen: Zehn VS-Zellen pro Hirnhälfte reagieren zum Beispiel nur auf Rotationsbewegungen der Fliege. Dabei erhält jede dieser zehn Zellen ihre Informationen nur von einem schmalen vertikalen Streifen des Fliegenauges. Dieser „Augenstreifen“ ist das rezeptive Feld der entsprechenden Zelle. Da die VS-Zellen parallel zueinander angeordnet sind, decken ihre rezeptiven Felder das gesamte Sehfeld der Fliege ab (Abb. 4).
Die genauere Untersuchung der VS-Zellen brachte eine kleine Sensation ans Licht [6]: Die Zellen reagieren in ihrem Eingangsbereich, also dem Bereich, der Informationen aus der Medulla bekommt, wie erwartet nur auf Bewegungen aus ihrem rezeptiven Feld. Im Ausgangsbereich der Zelle reagierten die VS-Zellen jedoch auch auf Bewegungen aus den rezeptiven Feldern ihrer Nachbarzellen. Wie war das möglich? Es zeigte sich, dass VS-Zellen elektrisch mit ihren Nachbarzellen verbunden sind [7]. Durch die besondere Anordnung der Zellen kommt es so zu einer Art Reihenschaltung im Ausgangsbereich der Zellen. Ein verblüffendes Ergebnis, denn die meisten Nervenzellen sind über chemische Synapsen verbunden und nicht direkt elektrisch gekoppelt. Nach diesen Ergebnissen muss die bis dahin gängige Aussage, dass eine Nervenzelle ein bestimmtes rezeptives Feld besitzt, korrigiert werden. Zumindest bei VS-Zellen muss bei solchen Aussagen in Zukunft zwischen dem Eingangs- und dem Ausgangsbereich der Zelle unterschieden werden.
Ausblick
Die Arbeiten des Max-Planck-Instituts für Neurobiologie tragen entscheidend zum Verständnis der Vorgänge im Sehsystem der Fliegen bei. So ist zum Beispiel das Netzwerk der VS-Zellen nun einer der am besten verstandenen Schaltkreise des Nervensystems. Schritt für Schritt entschlüsseln die Martinsrieder Forscher das Bewegungssehen der Fliege und legen Grundlagen für ein besseres Verständnis allgemeiner Funktionen und Verschaltungen von Nervennetzwerken. Schon jetzt fließen die Daten der aufgeklärten Schaltkreise des Fliegenhirns in ein gemeinsames Robotik-Projekt mit der Technischen Universität München ein.



