Multiple Sklerose: eine vielschichtige Krankheit
Forschungsbericht (importiert) 2009 - Max-Planck-Institut für Neurobiologie
Die Multiple Sklerose (MS) ist die häufigste entzündliche Erkrankung des zentralen Nervensystems. Besonders in der westlichen Welt, also in Nord- und Mitteleuropa sowie in Nordamerika, ist MS sehr häufig. Allein in Deutschland sind zirka 120.000 Menschen an MS erkrankt.
Vielschichtige Krankheit
Charakteristisch für die Krankheit sind klar abgegrenzte Entzündungsherde im Gehirn und im Rückenmark (Abb. 1). Je nachdem, welcher Bereich des Nervensystems von diesen Entzündungen betroffen ist, entstehen unterschiedliche Beschwerden und Symptome. So können Lähmungen, Empfindungs- und Sehstörungen, aber auch Koordinations- und Gedächtnisprobleme auftreten. In unseren Breiten treten diese mit der MS einhergehenden Beschwerden meist in Schüben auf, die sich mit nahezu beschwerdefreien Zeiten ablösen.

Trotz der jahrzehntelangen Erforschung der Multiplen Sklerose ist nach wie vor nicht eindeutig geklärt, wie die Krankheit entsteht und was sie zum Ausbruch bringt. Dies liegt zum Teil an den besonders schwierigen Forschungsbedingungen: Die Krankheitsherde sind im empfindlichen Hirngewebe eingebettet und somit beim Menschen für wissenschaftliche Untersuchungen unerreichbar. Noch mehr als andere Zweige der Medizin ist die MS-Forschung daher auf geeignete Tiermodelle angewiesen, um die Krankheit zu untersuchen. Mit der gebotenen Vorsicht lassen sich die Erkenntnisse aus solchen Studien auf den Menschen übertragen.
Mittlerweile spricht vieles dafür, dass MS durch eine Autoimmunreaktion ausgelöst wird: Immunzellen, die den Körper eigentlich vor Gefahren wie Viren, Bakterien oder Tumoren schützen sollen, attackieren stattdessen körpereigenes Nervengewebe. Was diese Immunzellen aktiviert, wie sie es schaffen in das Hirngewebe einzudringen und welche Zielstrukturen die Immunzellen im Nervensystem erkennen und angreifen, das untersuchen Hartmut Wekerle und seine Mitarbeiter der Abteilung „Neuroimmunologie“ am Max-Planck-Institut für Neurobiologie in Martinsried. Ziel der Arbeiten ist es, die grundlegenden Abläufe und Mechanismen der Multiplen Sklerose zu verstehen. Einmalig über die Grenzen Deutschlands hinaus ist dabei die enge Kooperation zwischen Grundlagenforschern und Medizinern. Der rege Austausch von Informationen, Daten und Ideen zwischen den Mitarbeitern des MPI für Neurobiologie und Wissenschaftlern des Instituts für Klinische Neuroimmunologie der LMU München, geleitet von Reinhard Hohlfeld, ermöglicht eine MS-Forschung buchstäblich „von der Laborbank bis zum Krankenbett“. Das auf diese Weise erarbeitete Wissen kommt letztendlich immer dem Patienten zugute.
Fehlgeleitete Immunzellen
T- und B-Zellen des Immunsystems sind essentiell für die Abwehr von Krankheitserregern. Dabei stellen T-Zellen eine Art Sofortmaßnahme dar – sie erkennen Erreger, aktivieren die Immunantwort und lösen so die Zerstörung der schädlichen Zellen aus. B-Zellen reagieren dagegen auf einen Erregerkontakt, indem sie sich sehr rasch teilen und eine große Menge speziell auf den Erreger zugeschnittener Antikörper produzieren. Diese binden an die Zielstruktur des Erregers und leiten so dessen Zerstörung ein. Durch das gezielte Zusammenspiel von T- und B-Zellen können Krankheitserreger schnell und effektiv bekämpft werden.
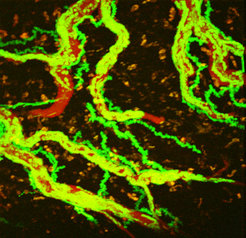
In den 80er-Jahren des letzten Jahrhunderts fanden Wissenschaftler heraus, dass T-Zellen Bestandteile des körpereigenen Hirngewebes erkennen und angreifen können. Daraufhin markierten die Martinsrieder Neuroimmunologen aggressive T-Zellen mit einem Fluoreszenzfarbstoff (Abb. 2) und zeigten, dass die Zellen zunächst mehrere Tage durch die peripheren Immunorgane wie Lymphknoten und Milz wandern, bevor sie in das Nervensystem eindringen [1]. Offenbar erwerben die Zellen erst auf ihrem Weg die Fähigkeit, in das zentrale Nervensystem einzudringen – eine beachtliche Leistung. Denn das Nervensystem wird von hoch spezialisierten Blutgefäßen versorgt. Die Wände dieser Gefäße bilden die sogenannte Blut-Hirn-Schranke, die für im Blut zirkulierende Zellen und viele kleinere Partikel unpassierbar ist; die Nervenzellen sind geschützt. Aufgrund dieser normalerweise sehr effektiven Trennung zwischen dem zentralen Nervensystem und dem Blutkreislauf war es lange Zeit rätselhaft, wie Immunzellen die Blut-Hirn-Schranke durchbrechen können. Nun konnten die Max-Planck-Forscher zusammen mit Kollegen der Universitätsmedizin Göttingen das erste Mal direkt durch ein Zwei-Photonen-Mikroskop beobachten, wie lebende T-Zellen die Blutgefäße verlassen und ins Hirngewebe eindringen [2]. Dazu markierten die Wissenschaftler aggressive T-Zellen mit dem Grün Fluoreszierenden Protein (GFP) in Ratten und sahen so, dass T-Zellen die Blut-Hirn-Schranke in mehreren Schritten überwinden. Außerhalb des Nervensystems bewegten sich die markierten Zellen wie erwartet: Die meisten ließen sich vom Blutstrom treiben. Nur vereinzelt blieben Zellen für kurze Zeit an den Gefäßwänden haften, bevor sie in Richtung des Blutstroms weiterrollten oder wieder mitgerissen wurden. Erreichten die T-Zellen jedoch die Gefäße des zentralen Nervensystems, so verhielten sie sich völlig anders. Immer häufiger beobachteten die Wissenschaftler, wie sich T-Zellen an den Gefäßwänden festsetzten. Ab einem bestimmten Zeitpunkt zeigten die Zellen dann ein für T-Zellen bisher gänzlich unbekanntes Verhalten: Sie bewegten sich aktiv und gegen den Blutstrom entlang der Gefäßwände. Diese Suchbewegung konnte mehrere Minuten bis Stunden andauern, bevor die Zellen entweder vom Blutstrom wieder mitgerissen wurden oder sich durch die Gefäßwand zwängten.
Folgenschwere Begegnungen
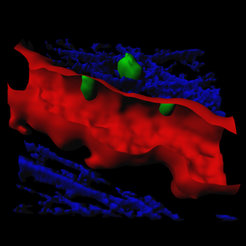
Hatten die T-Zellen die Barriere der Blut-Hirn-Schranke erfolgreich durchbrochen, setzten sie ihre Suche im Umkreis der Blutgefäße fort. So war es nur eine Frage der Zeit, bis sie auf eine der sogenannten Fresszellen stießen. Fresszellen sitzen an den Außenwänden der Blutgefäße und auf der Oberfläche des Nervengewebes, wo sie ihre Umgebung mit fingerartigen Zellausstülpungen systematisch abtasten. Dass T-Zellen erst mit Fresszellen in Kontakt treten müssen, um ihre Immunfunktion auszuüben, ist seit längerem bekannt. Völlig neu ist jetzt, dass Forscher erstmals solche Interaktionen direkt an der Blut-Hirn-Schranke beobachten können (Abb. 3). Und tatsächlich begannen die T-Zellen erst nach dem Kontakt mit den Fresszellen entzündungsfördernde Botenstoffe auszuschütten und so den Angriff auf das Nervensystem einzuleiten. Als eine der Folgen durchquerten immer mehr T-Zellen die Wände der Blutgefäße. Die Begegnung von T- und Fresszellen an der Grenze zum Nervengewebe scheint somit ein entscheidendes Signal für die Invasion der Immunzellen zu sein.
Aggressiver als andere
Diese spannenden Beobachtungen an der Blut-Hirn-Schranke waren jedoch nicht die einzigen neuen Erkenntnisse der Martinsrieder Forscher zum Verhalten der T-Zellen [3]. Manche T-Zellen sind deutlich aggressiver als andere – der Grund hierfür war jedoch unklar. Die Martinsrieder Neuroimmunologen untersuchten daher eine Gruppe dieser „speziellen“ T-Zellen, die ein Protein (MOG) auf der Oberfläche von Hirnzellen erkennt und attackiert. Zur großen Überraschung der Wissenschaftler griffen diese T-Zellen auch dann noch das Hirngewebe von Mäusen an, wenn MOG fehlte – eigentlich sollten die T-Zellen ohne MOG keinen Angriffspunkt im Gehirn mehr finden. Erst eine groß angelegte biochemische Untersuchung brachte des Rätsels Lösung: T-Zellen, die MOG als Fremdkörper erkennen, reagieren auch noch auf ein zweites, völlig anderes Protein im Gehirn. Diese „doppelte Aktivierung“ von bestimmten T-Zellen könnte der Grund für ihre deutlich höhere Aggressivität sein. Eine wichtige Erkenntnis, denn nun kann nach Wegen gesucht werden, um diese speziellen T-Zellen im Patienten zu identifizieren. Darauf aufbauend könnten Therapien entwickelt werden, die ganz spezifisch die Aktivität dieser besonders aggressiven T-Zellen unterdrücken oder sie aus dem Gewebe entfernen.
Verkannte Bedeutung
Anders als den T-Zellen wurde den B-Zellen bisher nur eine untergeordnete Rolle bei der Entstehung der MS eingeräumt. Zu Unrecht, wie die Martinsrieder Wissenschaftler nun mithilfe eines ganz besonderen Tiermodells herausfanden [4]. Zusammen mit einem internationalen Team gelang es ihnen spezielle Mäuse zu züchten, die das MS-Krankheitsbild spontan ausbilden. Der Verlauf der Krankheit zeigte dann das in unseren Breiten typische schubförmige Muster der menschlichen MS-Form. Das neue Modell ist daher allen bisherigen Modellen überlegen, die erst nach einer Injektion mit Hirngewebe Symptome der MS und keine Schübe zeigen. Nun zeigte sich schnell, dass die tatsächliche Rolle der B-Zellen bei den bisherigen Krankheitsmodellen nur nicht zum Vorschein gekommen war. Zwar greifen auch im neuen Mausmodell T-Zellen das körpereigene Hirngewebe an. Dies reicht jedoch nicht aus, um die Krankheit auszulösen: Entfernten die Wissenschaftler die B-Zellen, so blieben die Tiere gesund. Diese Beobachtung widerlegt die herrschende Lehrmeinung, nach der allein die T-Zellen für den Ausbruch der Krankheit verantwortlich sind. Jetzt ist klar, dass es erst zu einer Interaktion zwischen T- und B-Zellen kommen muss, bevor die daraus entstehenden Antikörpermassen die Krankheit voll auslösen können.
Antikörper im Kopf
B-Zellen sind somit essentiell für die Entstehung der MS, und auch am Angriff auf die Nervenzellen sind sie mit ihren Antikörpern massiv beteiligt (Abb. 4). So ist eine große Menge Antikörper in der Gehirn- und Rückenmarksflüssigkeit (dem Liquor) ein Diagnosekriterium der MS.
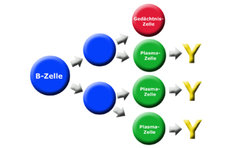
Doch woher kommen diese Antikörper? Werden sie von den relativ wenigen B-Zellen im Liquor gebildet, oder passieren sie ebenfalls die Blut-Hirn-Schranke und stammen aus dem Blut oder lymphatischen Organen, wo sich der Großteil der Antikörper-produzierenden B-Zellen befindet? Um diese Frage zu klären, haben die Martinsrieder Neurobiologen zusammen mit Kollegen vom MPI für Biochemie und dem Klinikum der Universität München (LMU) ein neues Verfahren entwickelt, mit dem Antikörper und B-Zellen einander zugeordnet werden können [5]. Die Wissenschaftler analysierten zum einen den für die Antikörper zuständigen genetischen Code von B-Zellen aus dem Liquor. Mit diesen Daten war es möglich, am Computer zu errechnen, wie groß bzw. schwer bestimmte Fragmente des von der B-Zelle gebildeten Antikörpers wären. Zum anderen reinigten die Wissenschaftler die Antikörper direkt aus dem Liquor und bestimmten die Gewichte ihrer Fragmente. Der Vergleich dieser beiden Datensätze war eindeutig: Die Antikörper im Liquor werden von den dort ebenfalls vorhandenen B-Zellen produziert. Als nächstes wollen die Wissenschaftler nun die Fragmente der Antikörper zu ganzen Antikörpern zusammenzusetzen, um so die attackierten Zielstrukturen im Nervensystem zu identifizieren. Denn woran die Antikörper genau binden, ist in den meisten Fällen nach wie vor unbekannt. Kein Wunder, denn die Immunzellen können im Prinzip jeden Bestandteil des Nervensystems als Fremdkörper fehldeuten.
Viele kleine Schritte
Die Arbeiten der Neuroimmunologen des Max-Planck-Instituts für Neurobiologie tragen zu einem immer besseren Verständnis der Ursachen und Mechanismen der Multiplen Sklerose bei. Eine Grundvoraussetzung für die Entwicklung erfolgreicher Therapien. Bereits heute zeichnet sich ab, dass durch die MS-Forschung in nicht allzu ferner Zukunft eine Situation wie beim Krebs erreicht werden kann: Es gibt zwar nicht den Durchbruch, doch die vielen kleinen und größeren Fortschritte führen zu einer Vielzahl an wirksamen Therapien, sodass in der Summe der Patient eine wirkliche Verbesserung erfährt.



