"Rundum-Service" für alternde Nervenzellen
Forschungsbericht (importiert) 2007 - Max-Planck-Institut für Neurobiologie
Schüttellähmung
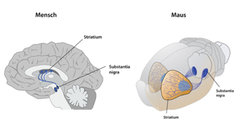
Als James Parkinson 1817 seine „Abhandlung über die Schüttellähmung“ verfasste, beschrieb er zum ersten Mal eine Krankheit, an der heute allein in Deutschland über 300.000 Menschen leiden. Das auffälligste Symptom der Parkinson-Krankheit ist ein relativ langsames Muskelzittern. Dies geht einher mit einer zunehmenden Bewegungsarmut und Beugung des gesamten Körpers. Diese Symptome, die meist erst ab dem 50. Lebensjahr auftreten, sind Zeichen einer dramatischen Veränderung im Gehirn der Patienten: In der Substantia nigra, einem Bereich im Mittelhirn, sterben Nervenzellen in großer Zahl. Diese Nervenzellen stellen normalerweise den Botenstoff Dopamin her, der unter anderem für die Bewegungskoordination wichtig ist (Abb. 1).
Zwar verliert auch der gesunde Mensch mit fortschreitendem Alter zunehmend Nervenzellen in diesem Bereich, doch bei Parkinson-Patienten ist dieser Prozess stark beschleunigt. Häufig wird jedoch die Parkinson-Krankheit erst spät erkannt, da die klassischen Parkinson Symptome erst dann auftreten, wenn bereits rund die Hälfte der Dopamin-produzierenden Nervenzellen abgestorben ist.
Trotz der nun fast 200 Jahre währenden Erforschung der Parkinson-Krankheit sind ihre Ursachen und die molekularen Veränderungen im Gehirn noch immer nicht vollständig geklärt. Die Fortschritte der letzten Jahre im Bereich der Molekularbiologie, Genetik und Mikroskopie ermöglichen nun jedoch immer tiefere Einblicke in die Vorgänge des Gehirns. Neurobiologen sind den Mechanismen auf der Spur, die dafür sorgen, dass Nervenzellen in der Substantia nigra eben nicht wie bei Parkinson-Patienten frühzeitig absterben.
Nervenwachstumsfaktoren – die Beschützer
Schnell fiel die Aufmerksamkeit der Wissenschaftler auf die Nervenwachstumsfaktoren. Dies sind körpereigene Proteine, die das Überleben von Nervenzellen fördern. Nervenwachstumsfaktoren können zum Beispiel Nervenzellen vor Giftstoffen schützen oder verhindern, dass die Zellen ihr eingebautes Zelltod-Programm starten. Verschiedene Versuche deuteten darauf hin, dass der Nervenwachstumsfaktor GDNF den frühen Tod von Nervenzellen in der Substantia nigra verhindern kann. Bisher war es jedoch nicht möglich, dies im erwachsenen und alternden Gehirn zu untersuchen, da Tiere mit künstlich ausgeschalteten Nervenwachstumsfaktoren oder künstlich lahmgelegten Rezeptoren nicht lebensfähig sind. Doch gerade im alternden Gehirn findet der dramatische Verlust von Nervenzellen sowohl bei der Parkinson-Krankheit als auch bei vielen anderen neurodegenerativen Krankheiten statt.
Um den Einfluss des sich leicht verteilenden GDNF auch im alternden Gehirn untersuchen zu können, suchten die Wissenschaftler nach einer Möglichkeit, den Rezeptor für GDNF (genannt „Ret“) selektiv auszuschalten. Denn man vermutete, dass GDNF erst durch die Bindung an Ret seine lebensverlängernde Wirkung erzielen kann. Tatsächlich gelang es den Neurobiologen, die Ret-Rezeptoren ganz gezielt nur in Dopamin-produzierenden Nervenzellen der Substantia nigra auszuschalten. Die so veränderten Mäuse sind lebensfähig und haben eine normale Lebenserwartung (Abb. 2). So war es erstmals möglich, die Auswirkungen des fehlenden GDNF-Signals auf die Entwicklung und langfristige Erhaltung von Nervenzellen in der Substantia nigra zu untersuchen [1].
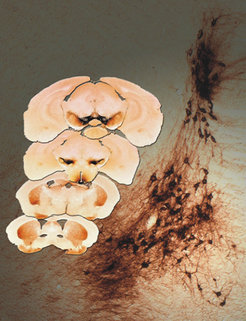
GDNF – Lebenselixier für alternde Nervenzellen
Erstaunlicherweise entwickelten sich die Zellen in der Substantia nigra auch ohne den Ret-Rezeptor ganz normal. Dass GDNF an den rezeptorlosen Neuronen nicht andocken kann, machte sich erst im Erwachsenenalter deutlich bemerkbar: Die Nervenzellen starben verfrüht, und je älter die Tiere wurden, desto mehr Nervenzellen starben ab. Noch sind jedoch nicht alle notwendigen Überlebensfaktoren für diese Zellen bekannt und es fehlen noch einige Puzzleteile, um die Ursachen des pathologischen Zellsterbens bei der Parkinson-Krankheit ganz zu verstehen.
Parallel zu diesen Experimenten wurde anderenorts in klinischen Studien untersucht, ob eine Gabe von GDNF eine positive Wirkung auf den Krankheitsverlauf bei Parkinson-Patienten hat. Die Ergebnisse dieser klinischen Tests sind derzeit jedoch nicht eindeutig – in manchen Studien zeigten Patienten eine deutliche Linderung, während in anderen Studien kein Effekt festgestellt wurde. Diese Untersuchungen warfen nicht nur Fragen zu den Verabreichungsmethoden von GDNF auf. Sie zeigten auch, dass ein tieferes Verständnis der molekularen Mechanismen von GDNF und seinem Ret-Rezeptor notwendig ist, um die Erfolgsaussichten eines Wachstumsfaktor-basierten Therapieansatzes zu verbessern. Mithilfe von genetisch modifizierten Mäusen stellten sich Edgar Kramer und Kollegen dieser Herausforderung [2].
Schadensbegrenzung durch GDNF
Um die Vorgänge und den Verlauf der Parkinson-Krankheit untersuchen zu können, ist es möglich, einen Parkinson-ähnlichen Zustand durch die Gabe des Giftes MPTP künstlich herbeizuführen. Auf die Wirkung von MPTP wurde man erstmals aufmerksam, als dieses Nebenprodukt der Designerdroge MPPP (auch „synthetisches Heroin“ genannt) Parkinson-ähnliche Symptome bei den Konsumenten hervorrief. Ähnlich wie bei der Parkinson-Krankheit sterben durch die Einnahme von MPTP die Dopamin-produzierenden Nervenzellen in der Substantia nigra ab. Es zeigte sich, dass der Ret-Rezeptor nicht nur, wie zuvor gezeigt, das Überleben der Nervenzellen fördert, sondern auch ihre Regeneration: Zwar starb die gleiche Anzahl an Nervenzellen in der Substantia nigra nach Gabe von MPTP ab, egal, ob sie den Ret-Rezeptor hatten oder nicht. Jedoch zeigte sich nur in Zellen mit Ret-Rezeptoren, an die GDNF noch binden konnte, etwas Erstaunliches: Nach Absetzen des MPTP begannen die Nervenzellen, sich neu zu verzweigen (Abb. 3). Der Aufbau neuer Kontakte zwischen den verbliebenen Nervenzellen kann die Lücke im Informationsnetzwerk, entstanden durch abgestorbene Nervenzellen, zumindest zum Teil kompensieren – aber eben nur, wenn GDNF und Ret-Rezeptor vorhanden sind.

Besseres Verständnis der zugrunde liegenden Vorgänge
Die Ergebnisse dieser Studien zeigen, dass der Nervenwachstumsfaktor GDNF und sein Rezeptor Ret essenziell für das Überleben von Nervenzellen in der Substantia nigra sind. Werden diese Zellen geschädigt, wie zum Beispiel durch das Nervengift MPTP, dann ermöglichen GDNF/Ret die Regeneration von Zellkontakten und tragen so zur Schadensbegrenzung bei. Die Ergebnisse können die Entwicklung besserer Therapieformen der Parkinson-Krankheit vorantreiben. Zum Beispiel könnte eine rechtzeitige Gabe von GDNF oder einem anderen Ret-Aktivator den Ausbruch der Parkinson-Krankheit verhindern oder bereits symptomatischen Parkinson-Patienten zusammen mit anderen Medikamenten Linderung verschaffen und das weitere Fortschreiten der Erkrankung verlangsamen.


